
Эндометриоз является одной из актуальных проблем современной медицины, оставаясь в ряду самых загадочных и труднообъяснимых заболеваний. Частота эндометриоза, по данным разных исследователей, варьирует от 12 до 50% у женщин репродуктивного возраста. Согласно последним данным, эндометриозом во всем мире страдают примерно 176 млн женщин преимущественно репродуктивного возраста – каждая десятая. В России в структуре гинекологической патологии ГЭ занимает третье место (после воспалительных заболеваний и лейомиомы матки).
Частота выявления эндометриоза при лапароскопии, в том числе проводимой с целью уточнения причины бесплодия, составляет 20-55%. Среди обращающихся в центры вспомогательных репродуктивных технологий для проведения ЭКО более 30% пациенток имеет наружный генитальный эндометриоз.
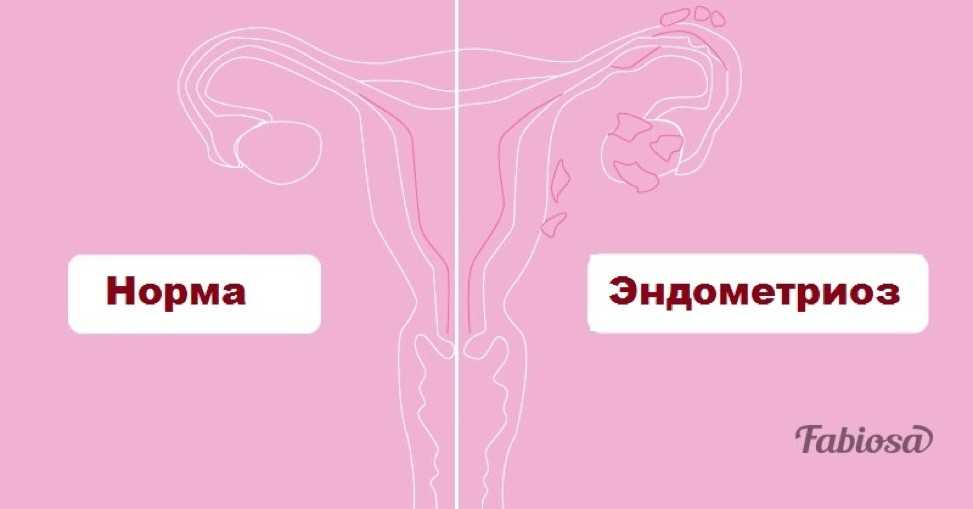
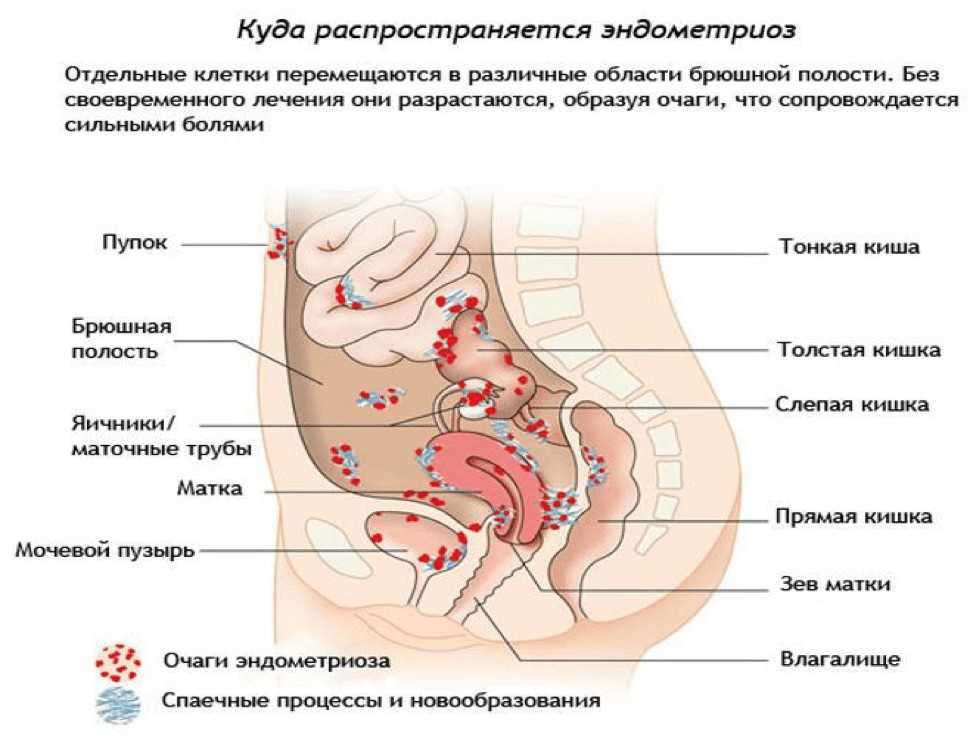
Согласно общепризнанному определению эндометриоз – патологический процесс, формирующийся на фоне нарушенных гормонального и иммунного гомеостазов и характеризующийся ростом и развитием ткани идентичной по структуре и функции с эндометрием, за пределами границ нормальной локализации слизистой оболочки тела матки. Эндометриоз обладает способностью к инфильтративному росту в окружающие ткани и органы с их последующей деструкцией. Эндометриоз также способен распространяться по кровеносным сосудам, то есть обладает способностью к метастазированию. Существует множество теорий патогенеза эндометриоза. Среди них можно выделить шесть основных групп: транспортную (имплантационную, трансплантационную, иммиграционную, лимфогенной, гематогенной и ятрогенной диссеминации); метапластическую; эмбриональную; гормональную; иммунологическую; генетическую. Однако ни одна из концепций происхождения эндометриоза не в состоянии объяснить ключевой момент развития заболевания — имплантацию и превращение клетки эндометрия в эндометриоидный очаг. Очевидно, этот процесс невозможен без определенных условий: регургитированные клетки эндометрия обладают повышенной способностью к выживанию, адгезии, имплантации и пролиферации, а все эти процессы происходят на фоне активного неоангиогенеза. При этом защитные факторы организма не в состоянии обеспечить уничтожение (апоптоз) эктопических эндометриальных клеток. Реализация данных условий возможна под воздействием одного или нескольких факторов, комбинация которых может бесконечно варьировать: генетическая предрасположенность, нарушение местного и общего иммунитета, гормональный дисбаланс, нарушение метаболизма клеток эндометрия, нарушение в системах ангиогенеза, влияние неблагоприятной экологии, воспаление, механическая травма. Наибольшее же значение имеют воспалительные процессы, нарушения иммунологического статуса и гормональной регуляции, а также генетические факторы.
Результаты многочисленных исследований свидетельствуют, что развитие и прогрессирование наружного генитального эндометриоза происходят на фоне нарушенного иммунного равновесия, а именно активации В-лимфоцитарной системы при одновременном развитии Т-клеточного иммунодефицита. Иммунологическая теория возникновения НГЭ рассматривает образование очагов гетеротопий как результат воспалительного процесса, раздражения брюшины продуктами ретроградных менструаций, воздействия инфекций (особенно вирусных), применения кортикостероидов, иммунодепрессантов, ионизирующей радиации, влияния других факторов внешней среды, а также генетической обусловленности. Большое значение в пато- и гистогенезе НГЭ имеют цитокины и факторы роста. Цитокины, представляющие собой пептиды-медиаторы, способствуют межклеточному взаимодействию и являются универсальными регуляторами процессов воспаления. Их биологический потенциал состоит в регуляции взаимодействия макрофагов с элементами тканей, в формировании очагов воспаления и иммуномодуляции. Выявлено, что на системном уровне при НГЭ наблюдается значительная продукция провоспалительных цитокинов — фактора некроза опухолей α (ФНО-α) и интерлейкина-1р (ИЛ-1Р) (они увеличиваются в 2–3 раза). Это свидетельствует о хроническом воспалительном процессе, при котором происходит сниженная выработка лептина, чем нейтрализуется действие ингибиторов ароматазы Р450, обусловливая ее активацию, приводящую к патологическому увеличению синтеза эстрогенов. Важная роль в развитии НГЭ отводится процессам апоптоза. Подавление апоптоза приводит к выживанию активных, биологически нецелесообразных клеток эндометрия, которые в норме должны были бы само ликвидироваться в процессе менструального цикла. Регуляторами апоптоза, действующими на уровне целостного организма, являются гормоны. В позднюю фазу стадии пролиферации экспрессия ингибитора апоптоза протеина ВCL-2 (протоонкоген, кодирует цитоплазматический и мембранный белок клеток, ингибирующих апоптоз) максимально снижается, что усиливает апоптотическую самоликвидацию эндометриальных клеток, зараженных вирусом и биологически нецелесообразных, в том числе с высоким пролиферативным потенциалом. В данном случае апоптоз имеет защитный характер. Повышение экспрессии ВCL-2 и прекращение апоптоза являются важным механизмом, лежащим в основе патогенеза эндометриоидных гетеротопий. Неоангиогенез – ключевое звено в формировании и развитии различных форм эндометриоза, поскольку васкуляризация эндометриоидных имплантов является одним из наиболее важных факторов их инвазии в окружающую ткань. Неоангиогенез является фундаментальным процессом, обеспечивающим репарацию поврежденных тканей – заключительную стадию воспалительного процесса (пролиферация и репарация). Ангиогенез осуществляется посредством разветвления и разрастания имеющихся сосудов или образования новых сосудов из стволовых клеток костного мозга. Последние получили название «эндотелиальные клетки-предшественники» (ЭКП).
Ведущим клиническим проявлением эндометриоза являются болевой синдром и бесплодие. К болевому синдрому относят: дисменорею, диспареунию, дисхезизию, хроническую тазовую боль. Выраженность болевого синдрома при эндометриозе зависят от локализации эндометриоидных гетеротопий, степени или стадии распространения процесса и поражения эндометриозом смежных органов, а также от длительности заболевания и индивидуальных особенностей пациенток.
Мнения специалистов об эндометриозе как причине бесплодия достаточно противоречивы, и если тяжелые формы действительно являются причиной бесплодия, то начальные проявления заболевания многие ученые не рассматривают как фактор бесплодия. Потенциально провоцировать субфертильность при аденомиозе могут следующие факторы: снижение рецептивности эндометрия за счет асептического воспаления, нарушения секреторной трансформации эндометрия. Инактивация сперматозоидов и повреждение эмбрионов перитонеальными макрофагами, которые чрезмерно усиливают свою активность под влиянием паракринных регуляторов и цитокинов, избыточно образующихся в очагах хронического воспаления, сопровождающего аденомиоз. Повышенная сократительная активность матки и динамическая трубная непроходимость при нарушении их перистальтики, вызванные отклонениями в простагландиновом обмене в гетеротопических очагах. Нарушение половой функции из-за выраженной диспареунии.
Наиболее выраженные изменения развиваются в матке. За счёт снижения экспрессии молекул адгезии интегрина, L-селектина, предецидуализации эндометрия вследствие повышенного синтеза простагландинов, нарушение регуляции экспрессии генов секреторной трансформации в следствие чего нарушается рецепторная функция матки.
Хирургическое лечение при бесплодии остаётся первым этапом при бесплодии ассоциированном с эндометриозом.
Хирургическое лечение при бесплодии, ассоциированном с эндометриозом – прагматичный подход. ( Paolo Vercellini, Edgarto Somigliana, Paolo Vigano, Annalisa Abbiati). Было выполнено 14 РКИ, в которых наглядно продемонстрировано, что совокупная частота беременности при проведении лапароскопического лечения и удаления участков эндометриоза от 6 до 18 месяцев в 50% случаев наступает беременность. У женщин, страдающих минимальным и лёгким эндометриозом (ASRM), лапароскопическое вмешательство по сравнению с диагностической лапароскопией является эффективным методом повышения частоты беременности/живорождений. (Jacobson, и соавт. 2010). Совокупный показатель частоты спонтанной беременности в течение 3 лет варьирует от 46 до 77% при умеренном эндометриозе и от 44 до 74% при тяжёлом эндометриозе ( Nezhat и соавт., 1989).
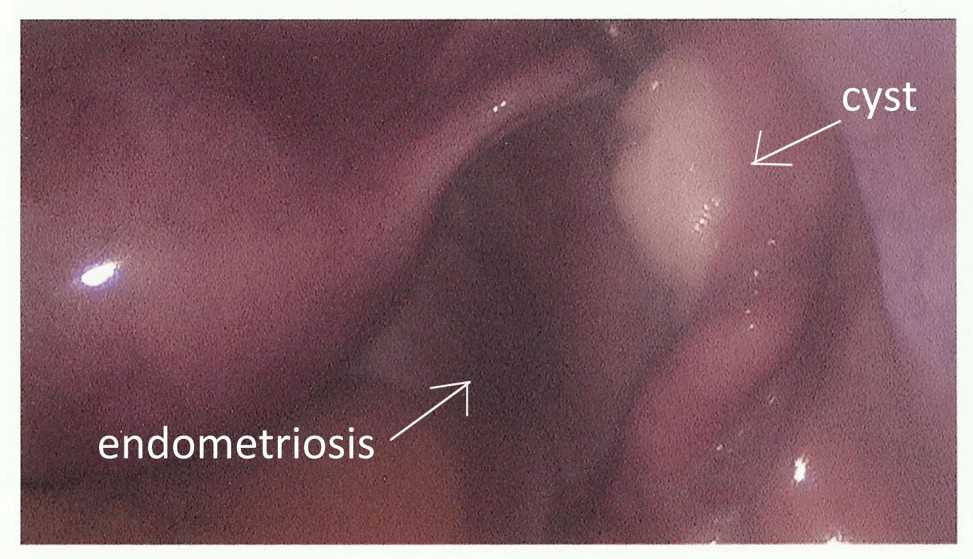
В ходе лапароскопии подсчитывают ряд показателей Индекса Фертильности при эндометриозе ( Endometriosis fertility index (EFI), предложенного G.D. Adamson. EFI имеет прогностическое значение: позволяет предсказать время наступления беременности и использовать выжидательную тактику у пациенток с хорошим прогнозом или сразу же приступить к процедурам ВРТ при неблагоприятном прогнозе.
У женщин с бесплодием вследствие эндометриоза, которым выполняется лапароскопическое вмешательство до применения ВРТ, клиницисты могут рассмотреть возможность полного хирургического удаления эндометриоидных очагов с целью улучшения частоты живорождениям( Opoien и соавт., 2011).
Парное исследование методом случай-контроль (Garcia-Velasco et al. 2004). Удаление эндометриом до проведения ЭКО не улучшает показатели фертильности.
Во главе эндометриоз-ассоциированного бесплодия лежит овариальный резерв и шанс родить собственного генетического ребенка.
Мета-анализ Edgardo Somigliana с соавт. на основании результатов ЭКО/ИКСИ у женщин, оперированных по поводу эндометриом двусторонней локализации: Количество антральных фолликулов и частота наступления беременности после лапароскопической эксцизии эндометриоидных кист яичников значительно уменьшаются.
Хирургическое вмешательство следует рекомендовать ( Garcia-Velasco, 2009)
Хирургическое удаление кист > 3-4 см:
Гормональная терапия для лечения бесплодия при эндометриозе до операции
При оценке отдельных вариантов гормональной терапии, применяемых для лечения боли, возникающей при эндометриозе, результаты сравнений не выявили достоверной разницы в рамках частоты живорождений при применении различных препаратов.
Рекомендации ESHRE (ур. А)
Женщинам, страдающим бесплодием вследствие эндометриоза, клиницисты не должны назначать гормональную терапию до хирургического лечения для подавления функции яичников с целью улучшения фертильности (Hughes с соавт., 2007).
Медикаментозное лечение после операции
8 РКИ (n=420) – применение гормональной терапии в послеоперационном периоде: увеличения частоты наступления беременности не наблюдалось.
Рекомендации ESHRE (ур. А)
Женщинам, страдающим бесплодием вследствие эндометриоза, клиницисты не должны назначать сопутствующую гормональную терапию после хирургического вмешательства с целью улучшения частоты спонтанной беременности (Furness с соавт., 2004).
По мнению экспертов ESHRE (2014 г.), хотя не следует назначать адъювантную гормональную терапию женщинам, страдающим бесплодием, связанным с эндометриозом, до хирургического лечения или после него в период ожидания ВРТ при наличии боли клиницисты не должны воздерживаться от применения такой терапии [Furness S, et al. Cochrane Database Syst Rev 2004:CD003678]. Все гормональные препараты блокируют овуляцию в течение всего времени их применения, поэтому представляется нецелесообразным использовать их у планирующих беременность женщин. Однако гормональная терапия широко используется для контроля боли и профилактики прогрессирования и рецидивов эндометриоза, что позволяет женщине сохранить фертильность и после ее отмены успешно забеременеть при условии правильного выбора сроков терапии и нужного препарата («bridge therapy»).
Стимуляция яичников с внутриматочной инсеминацией может использоваться только у пациенток с хорошим прогнозом при малой или умеренной форме эндометриоза в качестве единственного диагностированного фактора снижения фертильности. Согласно рекомендациям ESHRE (2014 г.), у женщин с эндометриозом I/II стадии по классификации AFS/ASRM можно рассматривать проведение контролируемой стимуляции яичников с внутриматочной инсеминацией в течение 6 мес. после хирургического лечения, при этом уровень клинической беременности сходен с таковым при бесплодии неясного генеза.
Медикаментозная супрессия перед применением вспомогательных репродуктивных технологий (ВРТ): агонисты ГнРГ. Как следует из результатов метаанализа трех рандомизированных контролируемых исследовании (РКИ), применение у женщин с эндометриозом II – IV стадии а-ГнРГ в течение 3-6 мес перед ВРТ привело к значительному увеличению частоты наступления беременности. При этом доза гонадотропинов, используемая в последующем цикле и, была сравнима с контролем, однако имела место статистическая разнородность (16)ст. Процент живорождения также был выше у этих женщин.
Рекомендации ESHRE (2014 г.), основанные на данных систематических обзоров и метаанализов, по ведению женщин с эндометриозом и бесплодием, которые согласуются с клиническими отечественными рекомендациями по эндометриозу (2013 г.)
Резюмируя следует сказать, что актуальность проблемы эндометриоза и особенно, бесплодия, не вызывает сомнения, также как и то, что решение многих вопросов далеко от своего завершения, что обуславливает необходимость дальнейших исследований.